|
先天性心髒病(congenital heart disease, CHD)是最常見的出生缺陷,在活産新生兒中的發(fā)病率約爲1%,也是胎兒宮内死亡的主要原因[1]。大多數CHD屬于複雜性疾病,遺傳變異在其發(fā)生中起(qǐ)重要作用。目前已發(fā)現部分CHD易感基因,但仍有70%以上的病例遺傳學(xué)病因未明[2]。
WD重複結構域62(WDR62)屬于WD40重複結構域蛋白家族,在細胞分裂期間定位于紡錘體微管上,參與中心粒的複制和紡錘體的組裝。以往研究表明WDR62基因突變及表達異常與小頭畸形、生殖系統疾病和癌症有關[3],但WDR62是否與CHD有關未見報道(dào)。
近日,複旦大學(xué)附屬兒科醫院黃國(guó)英教授和複旦大學(xué)基礎醫學(xué)院馬端教授團隊在Clinical and Translational Medicine(影響因子11.492,Q1區)期刊發(fā)表了題爲“WDR62 variants contribute to congenital heart disease by inhibiting cardiomyocyte proliferation”的研究論文。該團隊通過(guò)全外顯子組關聯分析結合多重PCR靶向(xiàng)測序,在大樣本散發(fā)CHD病例中發(fā)現WDR62具有較高的變異頻率;體内外實驗證實WDR62缺陷通過(guò)影響細胞周期和紡錘體組裝抑制心肌細胞增殖;從而确認了WDR62是CHD新的易感基因。

法洛四聯症(tetralogy of Fallot, TOF)是最常見的紫绀型CHD,嚴重威脅患兒生命和健康。該團隊首先對(duì)37例TOF患者和208例來自千人基因組計劃的漢族對(duì)照人群進(jìn)行了全外顯子組關聯分析,并對(duì)另外200例TOF患者進(jìn)行了一代測序驗證,共發(fā)現7個WDR62編碼區變異,斑馬魚實驗證明它們均爲功能(néng)喪失型變異。進(jìn)一步的小鼠模型研究發(fā)現,WDR62在胎鼠心髒發(fā)育早期的流出道(dào)及右心室心肌細胞中高表達,敲除Wdr62後(hòu)小鼠表現出流出道(dào)畸形、右心室發(fā)育不全和室間隔缺損。爲了觀察WDR62變異在不同類型CHD中的遺傳貢獻,研究團隊又對(duì)1083例與基因敲除小鼠相似心髒表型的CHD患者進(jìn)行了多重PCR靶向(xiàng)測序。最終在總共1320例CHD患者中發(fā)現WDR62變異頻率達到6%。
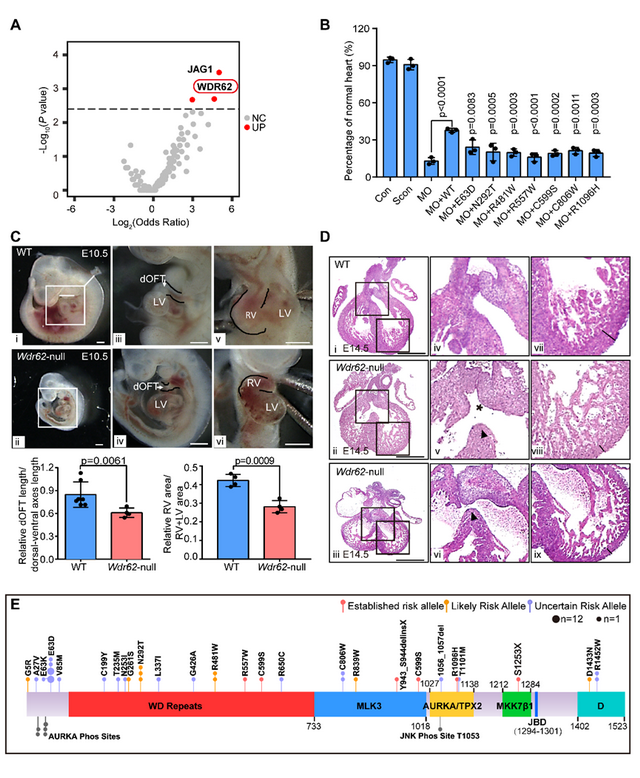
鑒于在心肌細胞系和小鼠模型中均發(fā)現WDR62缺陷導緻心肌細胞的細胞周期異常和多紡錘體極細胞比例增加,研究團隊又繼續探索了其中的分子機制,結果發(fā)現WDR62可調控心髒發(fā)育及心肌細胞增殖相關基因的表達,并可與有絲分裂激酶AURKA結合。WDR62缺陷減弱了其與AURKA在紡錘體極上的結合,減少了AURKA的磷酸化,使得WDR62和AURKA共同調控的細胞周期和紡錘體組裝相關靶基因的表達減少。
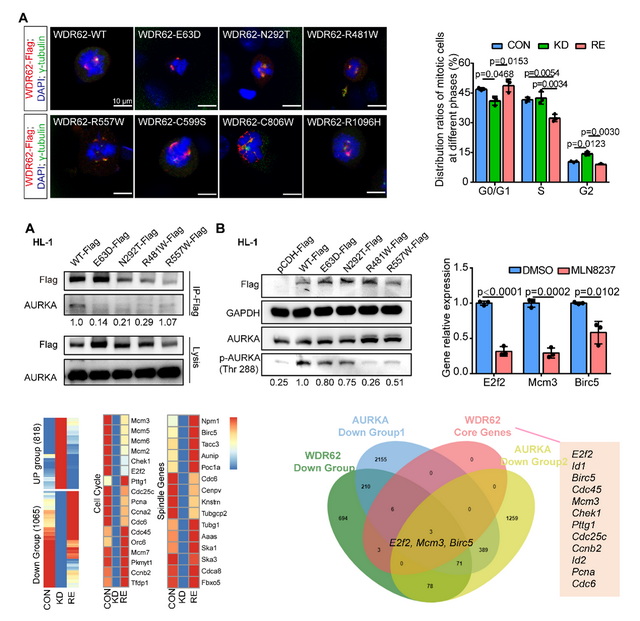
總而言之,該研究首次發(fā)現WDR62是CHD新的易感基因,而且闡釋了WDR62可通過(guò)調控心肌細胞中紡錘體組裝和細胞周期從而參與心髒發(fā)育。本研究的發(fā)現,有望用于TOF等部分嚴重複雜類型CHD早期分子診斷,指導優生優育。
複旦大學(xué)附屬兒科醫院郝麗麗、複旦大學(xué)附屬眼耳鼻喉科醫院馬競爲該論文共同第一作者,該研究受到國(guó)家重點研發(fā)計劃和國(guó)家自然科學(xué)基金等項目的資助。
[1]. Liu Y, Chen S, Zühlke L, et al. Global birth prevalence of congenital heart defects 1970-2017: updated systematic review and meta-analysis of 260 studies. International journal of epidemiology 2019;48:455-463.
[2]. Russell MW, Chung WK, Kaltman JR, Miller TA. Advances in the Understanding of the Genetic Determinants of Congenital Heart Disease and Their Impact on Clinical Outcomes. Journal of the American Heart Association 2018;7.
[3]. Shohayeb B, Lim NR, Ho U, et al. The Role of WD40-Repeat Protein 62 (MCPH2) in Brain Growth: Diverse Molecular and Cellular Mechanisms Required for Cortical Development. Molecular neurobiology 2018;55:5409-5424.
|
